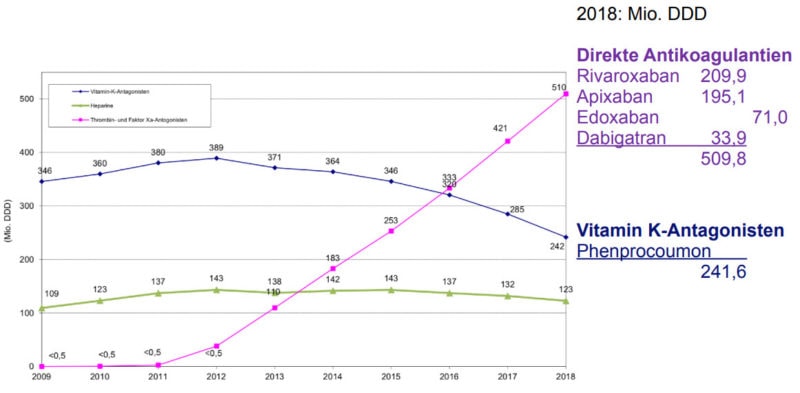
Blau: VKA, Grün: Heparine, Pink: Thrombin- und Faktor-Xa-Hemmer; Quelle: Arzneiverordnungsreport 2019 [1]
Andexanet alfa basiert auf endogenem Faktor Xa, ist aber nicht mehr katalytisch aktiv und die Bindungsdomaine an die Membran fehlt. So kann es den Faktor Xa-Inhibitor ohne katalytische Wirkung binden und neutralisieren. Andexanet alfa kann bei Blutungen unter einem Xaban intravenös injiziert werden und stoppt die Blutung. Weil der Wirkstoff eine kurze Bindungshalbwertszeit hat, wird er in einem Bolus verabreicht mit anschließender Infusion, bis die Blutung gestillt ist. In einer kürzlich erschienen Studie stoppte das Antidot bei 82 Prozent der Patienten eine Blutung unter Xaban [1].
Asthma: Benralizumab nur als Add-on
Mit Benralizumab (Fasenra®) ist ein Antikörper gegen schweres eosinophiles Asthma neu auf dem Markt, der sich gegen Interleukin 5 (IL-5) richtet. Zugelassen ist der Wirkstoff für Erwachsene mit schwerem eosinophilen Asthma, das trotz hochdosierter Kortikoide und Beta-Agonisten unzureichend kontrolliert ist. Für diese Patienten erkannte der Gemeinsame Bundesausschuss (G-BA) einen geringen Zusatznutzen von Benralizumab, wenn bereits alle anderen Möglichkeiten der Therapieeskalation ausgeschöpft wurden.
Es profitieren Patienten mit mehr als 300 Eosinophilen pro µl, berichtete Hein. Orale Glukokortikoide könnten unter Benralizumab niedriger dosiert werden. Der Wirkstoff ist nach den Leitlinien erst in Stufe 5 bei sonst ausgereizten Therapieoptionen eingeordnet. Exazerbationen würden nur eingeschränkt reduziert: Es trete etwa eine leichte Exazerbation in zwei Jahren weniger auf, berichtete die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) in 2018 [4]. Die Asthmakontrolle und die gesundheitsbezogene Lebensqualität steigere Benralizumab signifikant, die „Effekte lägen aber unterhalb der klinischen Relevanzgrenze“ (Änderung um 0,24-0,30 Punkte im ACQ-6- und AQLQ-Scrore).
Zudem seien die Tagestherapiekosten mit rund 60 Euro pro Tag vergleichsweise hoch. Umgerechnet müssten also rund 44.000 Euro ausgegeben werden, um eine Exazerbation zu verhindern, so die AkdÄ.
Zu den Nebenwirkungen zählen dem Arznei-Telegramm zufolge Kopfschmerzen, Fieber, Husten, Pharyngitis und Arthralgie. Bis zu 15 Prozent der Behandelten entwickelten Antikörper gegen Benralizumab, was die Wirksamkeit oder Sicherheit aber nicht beeinträchtige [3].
Weitere Option zur Migräneprophylaxe
Neben den in der Praxis inzwischen gut belegten Pharmaka gibt es nun zwei neue Antikörper zur Migräneprophylaxe: Mit Erenumab (Aimovig®) und Galcanezumab (Emgality®) können bei Migränepatienten mit vier bis 14 Anfällen pro Monat oder chronischer Migräne prophylaktisch behandelt werden. Galcanezumab bindet das vasodilatierende Calcitonin-Gene-Related-Peptide (CGRP), das bei akutem Anfall freigesetzt wird und vermutlich den Schmerz auslöst. Erenumab hingegen blockiert den CGRP-Rezeptor.
Der G-BA hat für Erenumab allerdings nur bei Patienten mit episodischer Migräne, die auf keine der zugelassenen prophylaktischen Substanzen ansprechen, einen beträchtlichen Zusatznutzen festgestellt. Für unbehandelte Patienten und Patienten mit unzureichendem Ansprechen sei ein Zusatznutzen nicht belegt. Gegenüber Placebo konnte Erenumab die Migränetage pro Monat u mehr als 50 Prozent reduzieren [1]. Der Effekt sei aber mit dem anderer Prophylaktika vergleichbar, wobei es besser verträglich zu sein scheint, so die AkdÄ [5].
Unerwünschte Ereignisse traten bei Erenumab nicht häufiger auf als unter Placebo [5]. Die meist leichten oder mäßigen Nebenwirkungen sind laut Arznei-Telegramm Reaktionen an der Injektionsstelle, Obstipation, Muskelspasmen und Juckreiz. Obwohl Die europäische und die amerikanische Arzneimittelbehörde einen Vorteil der 140-mg-Dosis für fraglich halten, wurde diese zugelassen, weil „einige Patienten … davon profitieren können“ [6]. Aus Sicht der AkdÄ reichen die bisherigen Daten nicht, um zu identifizieren, welche Patienten von der 70g- oder der 140g-Dosis profitieren [5]. Sie hält daher weitere Daten zum langfristigen Nutzen und Schaden für erforderlich. Die Therapiekosten von Erenumab liegen bei rund 24 Euro pro Tag [1].
Zoster-Impfung noch auf Privatrezept
Shingrix® ist ein rekombinanter Totimpfstoff, der zugelassen ist zur Vorbeugung von Herpes zoster Infektionen und postzosterischer Neuralgie ab 50 Jahren. Seit Mai bezahlen die gesetzlichen Krankenkassen die Impfung ab 60 Jahren, bei Risikogruppen auch ab 50. Derzeit müssen Ärzte oft noch Privatrezepte ausstellen, die die Patienten dann bei ihrer Kasse zur Kostenerstattung einreichen können. Denn regional sind die Verhandlungen von Kassen und Kassenärztlichen Vereinigungen zur Vergütung der Impfung noch nicht überall abgeschlossen.
Die Wirksamkeit des Impfstoffes gegen eine Infektion hängt vom Alter ab, beträgt aber mindestens 91,3 Prozent gegen Herpes zoster. Gegen postzosterische Neuralgie liegt die Wirksamkeit zwischen 50 und 70 Jahren bei 100 Prozent, bei älteren Patienten mindestens 71 Prozent [1]. Zu den Risikogruppen, bei denen laut STIKO die Indikation bereits ab 50 Jahren besteht, zählen Patienten mit HIV-Infektion, rheumatoider Arthritis, systemischem Lupus erythematodes, chronisch entzündlichen Darmerkrankungen, COPD, Asthma, chronischer Niereninsuffizienz oder Diabetes. Hein zufolge variiert das relative Risiko für Herpes zoster bei diesen Patienten zwischen 1,11 und 4,11 [1].
Nebenwirkungen sind dem Arznei-Telegramm zufolge sehr häufig, nehmen aber mit dem Alter etwas ab. Starke Schmerzen an der Einstichstelle, dass normale Alltagsaktivität nicht mehr möglich war, berichteten vier bis sieben Prozent der Anwender. Ähnlich starke Müdigkeit und Myalgien traten je nach Studie bei fünf bis sechs Prozent oder zwei bis drei Prozent auf [7].
Quellen:
- Hein L. Neue Arzneimittel 2018/2019 – eine kritische Bewertung, Symposium der Arzneimittelkommission der deutschen Ärzteschaft, DGIM, Wiesbaden, 6.5.2019; Vortrag online: https://www.akdae.de/Fortbildung/Vortraege/DGIM/2019/Thema-3-Folien.pdf (abgerufen am 13.5.19)
- Pressemitteilung der EMA, 1.3.2019: https://www.ema.europa.eu/en/news/first-antidote-reversal-anticoagulation-factor-xa-inhibitors-apixaban-rivaroxaban (abgerufen am 13.5.19)
- Wille H. Neue Arzneimittel 2017/18. Fortbildung der AkdÄ mit der KV Hamburg, Hamburg, 28.4.2018; Vortrag online: https://www.akdae.de/Fortbildung/Vortraege/TS/2018/Neue-Arzneimittel-2.pdf (abgerufen am 13.5.19)
- arznei-telegramm 2018; 49: 43-4
- AkdÄ-Stellungnahme zu Erenumab, 22.2.2019, online: https://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Erenumab/Erenumab-EB.pdf (abgerufen am 13.5.19)
- arznei-telegramm 2018; 49: 91-3
- arznei-telegramm 2018; 49: 49-51